NGUYÊN TỬ VÀ PHÓNG XẠ
Dương thị Tuấn Ngọc (Huy Hà ) Khóa 3 CĐ Nls
Dương thị Tuấn Ngọc (Huy Hà ) Khóa 3 CĐ Nls
Gồm:
Bài 1 : Cấu tạo của nguyên tử ( page 1)
Bai 2 : Phản ứng tách hạt và lò phản ứng hạt nhân (page 1)
Bài 3 : Sự phân rã của các chất thải từ lò phản ứng hạt nhân (page 1)
Bài 4 : Các tia phóng xạ độc hại từ đâu có? (page 2)
Bài 5 : Ảnh hưởng của phóng xa đối với cơ thể (page 2)
Bài 6 : Mức độ nhiễm xạ trong môi trường sống (page 3)
Bài 7 : Những bịnh do phóng xạ (page 3)
Bài 8 : Những môi trường nào có các loại phóng xạ ngoài lò phản ứng? (page 4)
Bài 9 : Làm sao để giảm thiểu lực tấn công của phóng xạ (page 4)
Bài10: Trị bịnh và sự giúp giảm bịnh về phóng xạ(page 4)
Bài 1 : CẤU TẠO CỦA NGUYÊN TỬ (STRUCTURE OF AN ATOM)
( Nucleus : Hạt nhân ; Proton : Dương điện tử ; Neutron : Trung hòa tử ; Electron : Âm điện tử e-)
Nguyên tử ( Atom) : Nguyên tử là phần nhỏ nhất của mỗi chất gồm có : Hạt nhân ( nucluer ) ở chính giữa, các âm điện tử ( electron) quây chung quanh . Trong hạt nhân có protons và neutrons .
Một Nguyên tử có cấu tạo giống như dạng hệ thống mặt trời , trong đó một Hạt nhân ( nucleus) giống như mặt trời đứng ở giữa và các electrons e- là các hành tinh quây liên tục chung quanh theo những quỹ đạo riêng của chúng với vân tốc rất nhanh , khoảng 1000km/sec .
Trong một Nguyên tử, số protons bằng với electrons , nên nguyên tử có trung tính ( neutral ) tỉ dụ Nguyên tử Carbon dưới đây :

Nguyên tử Carbon ( C ) có: 6 protons , 6 electrons nên nguyên tử carbon được trung tính (neutral) với 6 neutrons
Hiện nay ,thế giới vật chất trong trái đất nầy có tới 115 nguyên tử đã được tìm ra . Chúng đều có dạng thức giống nhau như trên, chỉ khác nhau số protons . Dưới đây là Bảng Phân Loại Nguyên tử mới nhất , trong đó thí dụ như Uranium ký hiệu là U có số dương điện tử (proton) là 92 .
Mỗi ô trong bảng là tên của mổi nguyên tử và có hai loại số : số trên là Atomic number là số điện tử dương (proton), số dưới gọi là Atomic mass (khối lượng nguyên tử)
Tóm tắc :
Number of Protons = Atomic Number
Number of Electrons = Number of Protons = Atomic Number
Number of Neutrons = Atomic Mass - Atomic Number
Number of Protons = Atomic Number
Number of Electrons = Number of Protons = Atomic Number
Number of Neutrons = Atomic Mass - Atomic Number
Thí dụ: U có khối lượng nguyên tử (atomic mass) là 238 , số điện tử dương (atomic number) là 92. Vậy số trung hoà tử (number of neutron) là : 238 – 92 = 146
Quây lại cấu tạo của một nguyên tử : Hạt nhân ở giửa, các elctrons quây chung quanh theo quỷ đạo riêng của chúng, khoảng cách từ hạt nhân đến các quỷ đạo là khoảng trống rổng ( empty space )
Empty space rất lớn , chiếm 99.9% thể tích của một nguyên tử . Còn lại là hạt nhân và các electrons chiếm 0.1 % .
Trọng khối nguyên tử (atom mass or weight): Hạt nhân chiếm hầu hết trọng khối 99.995% của một nguyên tử , còn các electron chiếm 0.05% .
Kích thước của nguyên tử : Kích thước quá nhỏ (very tiny) , trong 1cm = 50,000,000 đến 100,000,000 nguyên tử, nên nguyên tử quá nhỏ mắt thường không thể thấy được
Kích thước của Hạt nhân nhỏ hơn nguyên tử là 1/100,000 hoặc 1/200,000
Kích thước của hạt electron (e-) nhỏ hơn nguyên tử rất nhiều , nếu hạt nguyên tử bằng quả địa cầu, thì hạt electron chỉ bằng trái apple tức quả táo.
Kích thước của proton và neutron lớn hơn electron là 1836 lần .
Do đó tất cả các hạt đều không thể thấy được bằng mắt thường .
Để có khái niệm về Trọng lượng của nguyên tử :
1g Hydrogen có khoảng 5 x (10 lũy thừa 23) nguyên tử Hydro
1g Uranium chứa khoảng 1 x (10 lũy thừa 22) nguyên tử uranium . Uranium là kim loại nặng , tỉ trọng là 18.7
Lực mạnh của hạt nhân (strong nucleus force) là lực bao quanh kèm chặt các hạt protons và các hạt neutrons . Chính lực nầy sẽ đổi thành nhiệt khi nhân ( nucleus) bị tách ra để làm nóng nước trong lò phàn ứng hạt nhân .
Lực yếu của hạt nhân (weak nucleus force) là lực ở kẻ các hạt
Lực điện từ (electromagnetic force) là lực va đập hấp dẩn nhau giữa những điện tích âm dương của các protons và các electron .
Trọng lực (gravity) ở đây để chỉ lực hút của trái đất lên nguyên tử
Những nguyên tử đồng vị (Isotopes): những nguyên tử nào được gọi là đồng vị nhau khi chúng có cùng số proton (same atomic number), nhưng chúng có số neutron khác nhau (different number of neutrons).

C12 và C 14 là hai chất carbon đồng vị (isotopes), vì cùng có proton là 6 . C12 có tính bền, không phóng xạ nhưng C14 không bền có tính phóng xạ .
Những thí dụ khác:
1 ( U -238) có 92 (atomic number), có mass atomic là 238, nên có số neutron là 146 , có tánh bền .
( U-235) cũng có atomic number 92, nhưng mass atomic là 235, nên có số neutron 143, không bền và có tánh phóng xạ cao ( higher radioactivity) hơn (U-238)
2 Iodine I là một chất quan trọng cho sức khoẻ , thiếu iodine trong cơ thể có thể dẩn đến bướu cổ (goiter), Iodine rất cần trong Y khoa . Iodine-127, atomic number là 53 và Atomic mass là 127 vì vậy số neutron là 74. ( I-127 ) có tính bền , không phóng xạ ( not radioactive)
Iodine131 cũng có 53 điện tử dương (atomic number) nhưng Atomic mass là 131, do đó số neutron là 78 nên có tính không bền (unstable) . Tính phóng xạ half-life của nó là 8 ngày.
Tuyến giáp trạng (thyroid gland) cần iodine bền I-127 (gọi là iodine 127) , còn I-131 là không bền là radioactive isotope có tánh phóng xạ
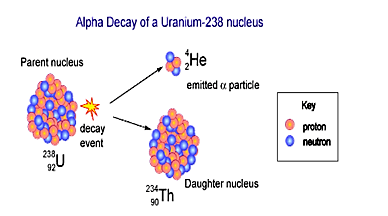
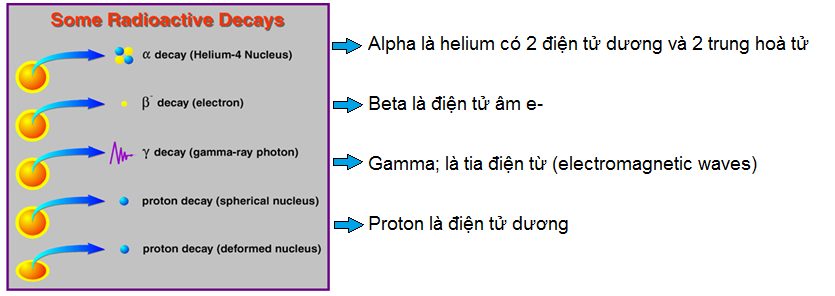
Sự di dời trong nguyên tử gọi là Transmutation or radioactive:
Những hạt e- trong một nguyên tử không bền có thể tự di dời một cách tự động , tự phát ( spontaneous) hoặc bị va chạm bởi một lực mạnh từ ngoài làm nó bắn các hạt trong nguyên tử của nó . Thí dụ : tia gamma phóng vào nguyên tử có thể làm văng một hay nhiều hạt điện tử âm e- ra khỏi nguyên tử
Đây là một nguyên tử không bền (unstable) nó có thể tự phát phóng xạ bất kỳ lúc nào nên được gọi là radioactive atom hay là transmutation in an atom .
Để kết thúc bài 1, thân ái mời các bạn xem qua video : Atomis structure biochemistry dưới đây :
-----oOo-----


 (theo Định Luật Bảo Tồn vật Chất Conservation theory). Người ta tính ra được 1kg uranium cho sản xuất ra 176 units (mà 1 unit là năng lượng cung cấp cho một người dân Mỹ xài trong 1 năm)
(theo Định Luật Bảo Tồn vật Chất Conservation theory). Người ta tính ra được 1kg uranium cho sản xuất ra 176 units (mà 1 unit là năng lượng cung cấp cho một người dân Mỹ xài trong 1 năm)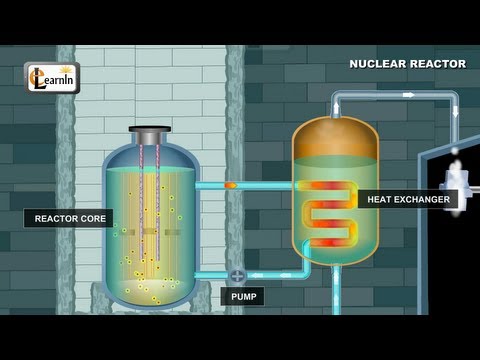






Comment